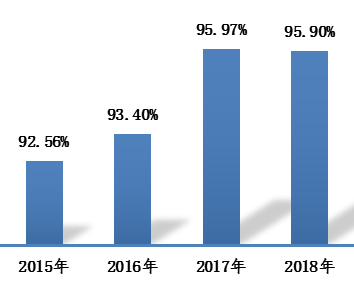|
国家医疗器械不良事件监测年度报告(2018年)
发布日期:2019-10-30
为全面反映2018年我国医疗器械不良事件监测情况,国家药品不良反应监测中心编撰了《国家医疗器械不良事件监测年度报告(2018年)》。 一、医疗器械不良事件监测工作进展 2018年,在全国医疗器械不良事件监测工作人员的开拓努力下,全国医疗器械不良事件监测工作持续推进,监测范围不断扩大,报告收集能力明显提升,报告数量继续增加。监测人员不良事件分析评价能力不断提高,有效提高了风险的发现和处置能力,生产企业不良事件监测主体责任逐步得到落实,医疗器械不良事件监测工作取得了新的进展: (一)推进监测信息系统建设,扩大网络覆盖提升数据质量 2018年,全国医疗器械不良事件监测信息系统接收可疑医疗器械不良事件报告40余万份,报告质量得到提高。系统基层注册用户达到27万余家,其中生产企业1.3万余家,较去年增长16.44%。全国95.9%的区县报告了医疗器械不良事件,每百万人口平均报告数为305份。此外,国家药品不良反应监测中心完成医疗器械不良事件监测新信息系统的搭建测试,实现了我国医疗器械不良事件在线报告系统的新旧更替,为《医疗器械不良事件监测和再评价管理办法》(以下简称《办法》)的贯彻落实提供有力支撑。 (二)夯实监测数据分析评价,挖掘产品风险促进用械安全 2018年,医疗器械不良事件监测风险信号评价处置工作深入开展。强化对全国医疗器械不良事件报告的日常监测、预警分析及季度汇总,根据发现的风险情况,全年共发布《医疗器械不良事件信息通报》3期、《医疗器械警戒快讯》6期。“十三五”医疗器械不良事件重点监测工作持续推进。国家药品不良反应监测中心组织对重点监测工作进行督查,相关承担单位主动收集监测数据,深入挖掘医疗器械风险,工作进展顺利。 (三)开展监测法规技术培训、积极参与国际交流,提升监测队伍水平 为配合新版《办法》的实施,国家药品不良反应监测中心全年共培训监测机构393人次,实现了对省级监测机构培训的全覆盖。各级监管部门组织开展了《办法》及相关指导原则的专项培训班,提升监测人员能力水平,强化生产企业主体责任。此外,积极跟进国际医疗器械监管机构论坛不良事件术语工作进展,推动我国加入国际医疗器械监管机构报告工作机制(NCAR),国际化水平进一步提升。 二、全国医疗器械不良事件报告总体情况 (一)年度报告总体情况 1.全国医疗器械不良事件报告数量 2018年,全国医疗器械不良事件监测信息系统共收到可疑医疗器械不良事件报告406974份,较2017年增长8.19%,反映出我国医疗器械不良事件报告意识不断增强、报告收集能力有效提升(图1)。
图1 2014-2018年全国可疑医疗器械不良事件报告数量
2.每百万人口平均报告数量 2018年,我国每百万人口平均可疑医疗器械不良事件报告数为305份,与2017年相比增长23份(图2)。
图2 2014-2018年全国每百万人口平均可疑医疗器械不良事件报告数比较
3.县级覆盖率 2018年,我国可疑医疗器械不良事件报告的县级覆盖率为95.9%(图3)。
图3 2015-2018年全国可疑医疗器械不良事件报告县级覆盖率
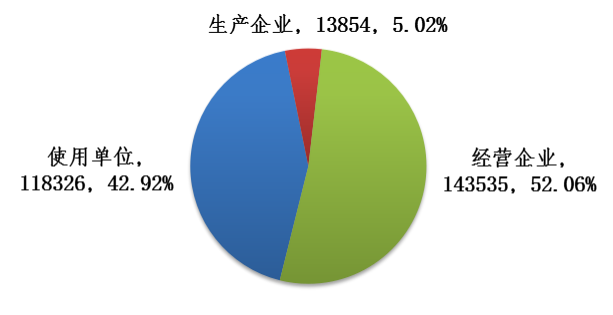
(二)全国注册基层用户数量 截至2018年12月31日,在全国医疗器械不良事件监测信息系统注册的基层用户(包括生产企业、经营企业和使用单位)共275715家,其中生产企业13854家,占注册基层用户总数的5.02%;经营企业143535家,占注册基层用户的52.06%;使用单位118326家,占注册基层用户的42.92%(图4)。
图4 2018年全国医疗器械不良事件监测信息系统注册基层用户情况
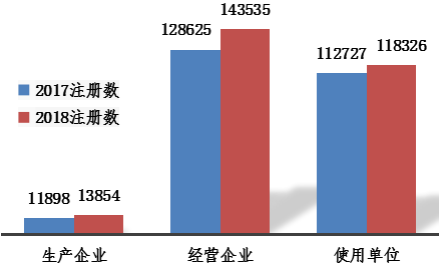
2018年,注册基层用户总数比2017年增长8.87%。显示我国医疗器械不良事件监测范围不断扩大。其中,生产企业、经营企业和使用单位的注册基层用户分别比2017年增长16.44%、11.59%和4.97%(图5)。
图5 2017、2018年全国注册基层用户分类比较情况
三、全国医疗器械不良事件报告统计分析 (一)按报告来源统计分析 2018年,全国医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,使用单位上报357652份,占报告总数的87.88%;生产企业上报10827份,占报告总数的2.66%;经营企业上报38340份,占报告总数的9.42%;个人报告148份,占报告总数的0.04%;7份报告来源不详(图6)。
图6 2018年可疑医疗器械不良事件报告来源情况
(二)按事件伤害程度统计分析 2018年,全国医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,事件伤害程度为死亡的报告138份,占报告总数的0.03%;事件伤害程度为严重伤害的报告68807份,占报告总数的16.91%;事件伤害程度为其他的报告338029份,占报告总数的83.06%(图7)。2018年各类伤害程度的报告所占比例与2017年基本一致。
图7 2018年可疑医疗器械不良事件报告事件伤害程度情况
2018年,对于事件后果为死亡的可疑医疗器械不良事件报告,国家药品不良反应监测中心均及时进行了处置,对事件与医疗器械的关联性进行了分析,其中绝大多数与涉及的医疗器械无明确相关性。在后续监测中,上述事件涉及的医疗器械,未发现风险异常增高情况。
(三)按医疗器械管理类别统计分析 2018年,全国医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,涉及第三类医疗器械的报告164760份,占报告总数的40.48%;涉及第二类医疗器械的报告209043份,占报告总数的51.37%;涉及第一类医疗器械的报告15277份,占报告总数的3.75%;部分报告涉及的医疗器械管理类别不详,共17894份占报告总数的4.40%。数据显示,涉及第二、三类医疗器械的报告占绝大多数,这与医疗器械风险程度高低相吻合(图8)。
图8 2018年可疑医疗器械不良事件报告涉及医疗器械管理类别情况
2018年,全国医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,报告数量排名前5位的无源医疗器械分别为一次性使用输液器、一次性使用无菌注射器、一次性使用静脉留置针、一次性使用导尿管(包)、宫内节育器;报告数量排名前5位的有源医疗器械分别为病人监护仪、输液泵和注射泵、血液透析机、心电图机、电子血压计。 (五)按涉及实际使用场所统计分析 2018年,全国医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,使用场所为“医疗机构”的报告341553份,占83.93%;使用场所为“家庭”的报告31927份,占7.84%;使用场所为“其他”的报告6341份,占1.56%;使用场所未填写的报告27153份,占6.67%(图9)。使用场所的复杂性是分析医疗器械不良事件发生原因时需要考量的因素之一。
图9 2018年可疑医疗器械不良事件报告涉及实际使用场所情况
四、医疗器械不良事件信息通报发布情况 为及时控制医疗器械风险,对可能出现的风险提出警示,2018年国家药品不良反应监测中心根据日常监测中发现的风险情况,汇总相关医疗器械的主要不良事件表现,发布了3期《医疗器械不良事件信息通报》,涉及一次性使用产包、有粉医用手套以及可重复用子宫探针三个产品,向相关生产企业、使用单位等提出风险控制建议。 五、医疗器械警戒快讯发布情况 2018年,国家药品不良反应监测中心密切跟踪全球医疗器械监管情况,发布6期《医疗器械警戒快讯》,汇总了美国、英国、澳大利亚以及加拿大发布的包括植入式心律转复除颤器、主动脉内球囊反搏泵、病人监护仪等医疗器械共30条安全性信息,为相关医疗器械在我国的安全性评价和风险控制提供参考借鉴。 六、有关情况说明 (一)本报告数据来源于全国医疗器械不良事件监测信息系统中2018年1月1日至2018年12月31日接收的数据。 (二)与大多数国家一样,我国医疗器械不良事件报告是通过自发报告系统收集并录入到数据库中,即当有人怀疑某种事件可能与医疗器械有关时,就可以上报。其判断受报告者主观意识、经验水平、认识程度、甚至所持立场影响,往往存在片面性和局限性,如伤害程度判读不准确、报告填写不规范、信息不完善等,甚至将与医疗器械无关的事情也按照不良事件上报,导致统计中出现偏差,且该报告系统无法计算不良事件发生率。 (三)不同医疗器械的不良事件报告数量受使用数量、风险程度、报告意识等诸多因素影响,故不良事件报告数量的多少不直接代表医疗器械的不良事件发生率高低或者风险严重程度。 (四)本报告中的统计结果均为对数据的真实反映,并非最终评价结果。
小贴士 1.医疗器械:是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是: (1)疾病的诊断、预防、监护、治疗或者缓解; (2)损伤的诊断、监护、治疗、缓解或者功能补偿; (3)生理结构或者生理过程的检验、替代、调节或者支持; (4)生命的支持或者维持; (5)妊娠控制; (6)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。 2.医疗器械不良事件:是指已上市的医疗器械,在正常使用情况下发生的、导致或者可能导致人体伤害的各种有害事件。 报告医疗器械不良事件应当遵循可疑即报的原则,即怀疑某事件为医疗器械不良事件时,均可以作为医疗器械不良事件进行报告。 医疗器械生产企业、经营企业和二级以上医疗机构应当注册为全国医疗器械不良事件监测系统用户,主动维护用户信息,报告医疗器械不良事件。其中生产企业应当持续跟踪和处理监测信息,产品注册信息发生变化的,应当在系统中立即更新。 3.医疗器械不良事件监测:是指对医疗器械不良事件的收集、报告、调查、分析、评价和控制的过程。 4.上市后定期风险评价报告:持有人(医疗器械生产企业)应当对上市医疗器械安全性进行持续研究,对产品的不良事件报告、监测资料和国内外风险信息进行汇总、分析,评价该产品的风险与受益,记录采取的风险控制措施,撰写上市后定期风险评价报告。
|
|