|
医疗器械警戒快讯 2025年第2期(总第216期)
发布日期:2025-03-12
医疗器械警戒快讯
(总第216期)
内容提要
美国FDA发布关于Boston Scientific公司Accolade起搏器可能需要提前更换的安全通报信息 发布日期:2025年2月21日 美国FDA提醒患者、护理人员和医疗保健提供者注意可能需要提前更换Boston Scientific公司Accolade起搏器,其中包括Accolade、Proponent、Essentio、Altrua 2标准寿命(SL)和延长寿命(EL)起搏器,以及Visionist和Valitude心脏再同步治疗起搏器。 Boston Scientific公司宣布召回部分Accolade起搏器设备,原因是这些设备存在永久进入安全模式的风险增加。在安全模式下,起搏器的功能将受到限制,可能导致无法正确调节部分患者心律。因此,应对已进入安全模式的设备进行更换。此次风险增加由制造问题导致电池电量不足引起。 虽然Boston Scientific公司的召回范围是部分进入安全模式风险增加的Accolade起搏器,但FDA正在与制造商合作评估所有Accolade起搏器设备中此问题的潜在风险,并根据需要制定其他缓解措施。 FDA发布此通知旨在提高对制造商召回通知、FDA与制造商的持续评估以及FDA当前建议的关注。 对患者和护理人员的建议 对医疗保健提供者的建议 器械说明 Accolade设备是一系列起搏器和心脏再同步治疗起搏器,用于治疗心律失常和中度至重度心力衰竭。 (美国FDA网站)
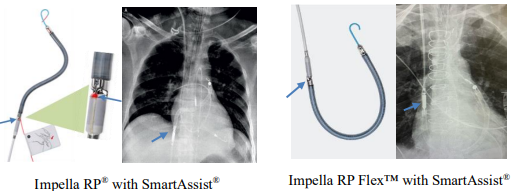
美国FDA发布关于Abiomed公司因与其他器械的交互问题更新Impella RP心脏泵使用说明的警示信息 发布日期:2025年2月14日 召回级别:FDA已将此次召回确定为最严重的类型。如果您不按照更新的说明继续使用此设备,可能会导致严重伤害或死亡。此次召回涉及更新器械的使用说明,并不涉及将其从使用或销售方撤回相关产品。 召回产品:
产品用途:带有SmartAssist系统导管的Impella RP Flex可用于左心室辅助装置植入后出现急性右心衰竭的患者,最长可使用14天。该装置通过下腔静脉插入肺动脉为右心系统提供血流动力学支持。 说明书更新原因:Abiomed公司已更新了带SmartAssist的Impella RP和带SmartAssist的Implla RP Flex的使用说明,因为在插入、调整或移除过程中,导丝或其他医疗器械的尖端可能会接触到Impella泵。这种相互作用可能会导致光学传感器损坏、泵临时停止或永久停止。这可能会触发报警,并导致某些心脏和血压读数丢失。 目前尚无相关伤害和死亡报告。 召回措施:2024年12月12日,Abiomed公司向所有受影响的客户发送了紧急医疗器械更正函,建议采取以下行动: (美国FDA网站)
美国FDA发布关于Medline Industries,LP公司由于导管材料脱落风险召回集成动脉导管的警示信息 发布日期:2025年2月6日 召回级别:FDA已将此次召回确定为最严重的类型如果继续使用该器械,可能会导致严重伤害或死亡。此次召回涉及从医疗器械使用单位或销售机构撤回部分器械。 产品名称:集成动脉导管 UDI及产品编号参见FDA网站: https://www.fda.gov/medical-devices/medical-device-recalls/arterial-catheter-recall-medline-industries-lp-removes-integrated-arterial-catheters-due-excess 召回原因:Medline Industries,LP公司正在召回集成动脉导管,该产品用于持续监测血压,以及采集患者的血液样本。Medline Industries,LP公司发现,因制造问题导致集成动脉导管接口部位存在多余材料。如果使用受影响的产品,多余材料可能会脱落,并可能从进针部位进入人体甚至血管内,导致严重的不良健康后果,包括血管栓塞和死亡。目前还没有收到伤害或死亡报告。 召回措施:Medline Industries,LP公司于2024年12月31日,向所有受影响的客户发送了一封医疗器械召回信,建议立即检查库存中是否有受影响的产品编号和批次,并隔离所有受影响的产品;客户填写并提交回复表后将收到更新后的标签;使用相关套件前先移除受影响的导管;转售或转让此产品的分销商和其他人员必须将此次召回通知到收货方。 (美国FDA网站)
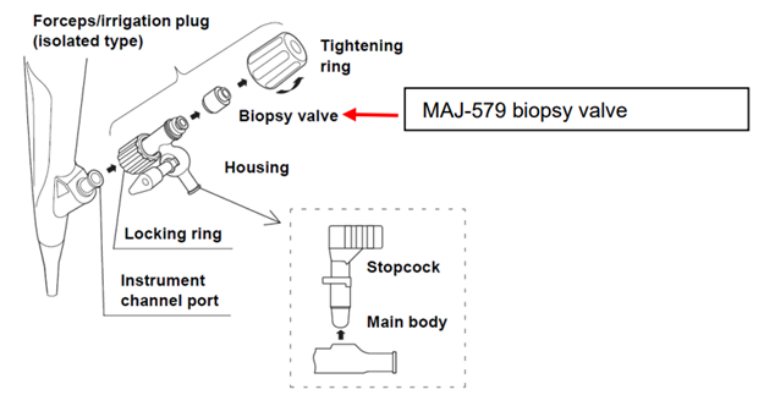
美国FDA发布关于Olympus公司因钳子/灌流插头问题召回内窥镜附件的警示更新信息 发布日期:2025年1月31日 召回类型:此次通讯信息是FDA增强医疗器械召回计划的通信试点的一部分。FDA已将此次召回确定为最严重的类型,如果继续使用该器械,可能会导致严重伤害或死亡。此次召回涉及从医疗器械使用单位或销售机构撤回部分器械。关于召回的产品和召回措施没有发生变化。 图 MAJ-891 钳子/灌流插头 受影响的产品: FDA了解到Olympus公司已向受影响的医疗保健提供者发出一封信,建议停止使用某些内窥镜的以下钳子/灌流插头附件: MAJ-891是内窥镜附件,用于连接到某些Olympus内窥镜的器械通道端口,包括膀胱镜(CYF系列)、输尿管镜(URF系列)、胆总管镜(CHF系列)和宫腔镜(HYF系列),这些内窥镜允许冲洗和使用内窥镜附件。MAJ-891已于2022年在美国市场停产。 召回原因: 当MAJ-891钳子/灌流插头再处理不当和/或不完整时,例如未将MAJ-891与内窥镜断开并在再处理前将其拆卸,则患者可能会因暴露于受污染的设备而发生感染。这种暴露可能导致患者受伤,包括感染、尿路感染或脓毒症,在某些情况下,还可能导致死亡。这些伤害可能需要患者住院治疗/监测,并口服或静脉注射抗生素治疗。 Olympus公司已经报告了120份伤害报告和1份因感染而死亡的报告,这些患者在手术中使用了配备MAJ-891附件的膀胱镜(CYF系列)。 召回措施: 2024年12月18日,Olympus公司向所有受影响的客户发送了紧急医疗器械警示通知,建议采取以下措施: 与MAJ-891兼容的Olympus内窥镜的完整列表以及MAJ-891的兼容替代设备详见以下链接:https://www.fda.gov/medical-devices/medical-device-recalls/update-alert-endoscope-accessories-forcepsirrigation-plug-issue-olympus (美国FDA网站)
美国FDA发布关于Nova Biomedical公司因传输错误检测结果的风险召回StatStrip葡萄糖和 StatStrip葡萄糖/酮医用检测仪的警示信息 发布日期:2025年1月30日 召回级别:FDA已经确认此次召回为最严重的等级,如果继续使用相关产品而不进行纠正,可能会导致严重伤害或死亡。此次召回涉及纠正相关产品,不涉及从使用机构或销售机构撤回相关产品。 受影响的产品: 产品用途: StatStrip葡萄糖医用检测仪用于医院和保健机构测量患者血液中的葡萄糖。该仪器可以测量从手指棒、血管或新生儿脚后跟棒收集的样本中的葡萄糖。它适用于成人、儿童和新生儿,包括接受重症监护支持的患者。StatStrip葡萄糖/酮医用检测仪和StatStrip葡萄糖/酮(mmol/L)医用检测仪也可测量患者血液中的酮,并且仅在美国境外销售。 召回原因: Nova Biomedical公司正在更正StatStrip葡萄糖和葡萄糖/酮医用检测仪,因为软件错误可能会导致不正确的葡萄糖和/或酮患者测试结果传输到医院医疗记录系统。当仪器仍在向记录系统无线传输当前检测结果时,操作员访问“查看结果”界面查看之前历史检测结果时,会出现此问题。在仪器更新到v.0.0.13.45版本软件之前,该问题可能会影响系统内的所有历史检测结果。 使用受影响的产品可能会导致严重的不良健康后果,这是因为根据不正确的血糖和/或酮水平做出了治疗决定,从而导致低血糖、高血糖或血液中酮水平高(酮血症或酮症酸中毒)。这种严重不良健康后果的风险在预期使用人群的子集(包括新生儿和接受重症医学护理的患者)中会升高。 目前没有收到伤害报告,也没有收到死亡报告。 采取措施: 请注意这个问题;但不需要采取任何行动。使用中的仪器已收到软件更新修正。其他仪器在投入临床使用前将由Nova Biomedical公司或当地经销商进行更新。 2024年11月20日,Nova Biomedical公司向所有受影响的客户发送了紧急现场纠正通知,其中包括以下信息: 客户应该采取以下措施: 2024年12月16日,Nova Biomedical公司向所有受影响的客户发送了经修订的紧急现场更正通知,提供以下附加信息: (美国FDA网站)

|
|