|
医疗器械警戒快讯 2024年第10期(总第212期)
发布日期:2024-11-01
医疗器械警戒快讯
(总第212期)
内容提要
加拿大Health Canada发布关于Olympus Medical公司因性能问题召回胃肠道视频内窥镜的警示信息 发布日期:2024年10月3日 召回级别:II级 召回产品:胃肠道视频内窥镜,具体型号和批次见下表:
制造商:Olympus Medical Systems Corp. 召回发起时间:2024年9月20日 召回原因:Olympus Medical公司在设备性能测试期间发现,CCD成像传感器的编程使用了不正确的色彩校正数据,因此不符合规格。 如需更多信息,请联系制造商。 (加拿大Health Canada网站)
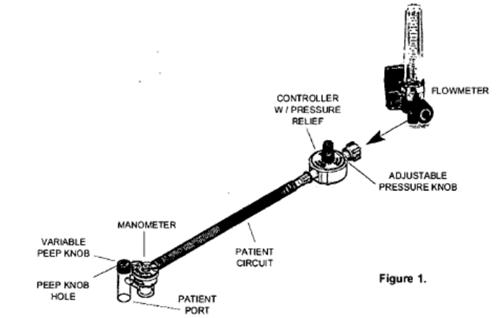
美国FDA发布关于Mercury Medical公司因在线控制器可能分离风险召回Neo-Tee T型复苏器的警示信息 发布日期:2024年10月7日 召回级别:此次召回涉及从医疗器械使用单位或销售机构召回部分器械。美国FDA已将此次召回识别为最严重的类型。如果继续使用该器械,可能会导致严重伤害或死亡。 受影响的产品 产品名称:Neo-Tee T型复苏器,带压力计和有泄压阀的控制器
产品用途:Neo-Tee T型复苏器是一种气体驱动的紧急复苏器,旨在通过面罩或患者气道中的导管提供紧急呼吸支持。它适用于新生儿和体重低于22磅的婴儿。 召回原因: Mercury Medical公司正在召回Neo-Tee复苏器,因为在线控制器可能会分离,导致正压损失,这将影响患者的有效通气,并阻止在线控制器的使用。美国客户如对此次召回有任何疑问,应联系Mercury Medical公司销售代表或Mercury Medical团队,电话800-237-6418/727-573-0088,邮箱regulatoryaffairs@mercurymed.com。 使用受影响的产品可能会导致严重的不良健康后果,包括缺氧损伤(缺血)和死亡。 没有伤害和死亡的报告。 采取措施 2024年9月4日,Mercury Medical公司向所有受影响的客户发送了紧急现场安全通知,建议采取以下措施: 医疗机构 经销商 (美国FDA网站)
美国FDA发布Zyno Medical公司因在线空气软件缺陷召回Z-800、Z-800F、Z-800W和Z800WF输液泵的警示信息 发布日期:2024年10月15日 召回级别:此次召回涉及从医疗器械使用单位或销售机构召回部分器械。美国FDA已将此次召回识别为最严重的类型。如果继续使用该器械,可能会导致严重伤害或死亡。 召回产品:
产品用途:Zyno Medical Z800输液泵用于在医护人员的指导或监督下,通过血管(静脉)输注营养或必需的(肠外)液体、血液和血液制品。 召回原因:Zyno Medical公司正在召回部分Z-800、Z-800F、Z-800W和Z-800WF输液泵,原因是Z800输液泵在线空气软件算法存在缺陷,可能导致把1.0mL气泡输注给患者。 使用相关产品可能会导致严重的不良健康后果,包括空气进入血管(空气栓塞)、心跳加快和不规则(快速性心律失常)、心脏病发作(心肌梗塞)、中风、癫痫发作和死亡。 已经收到2份因上述原因导致伤害的报告。目前还没收到相关死亡报告。 召回措施: 2024年9月13日,Zyno Medical LLC向所有受影响的客户发送了一封紧急医疗器械更正函,建议采取以下措施: Zyno Medical公司的合作伙伴Intuvie LLC的代表将与客户联系,协调更换产品的有关事宜。 (美国FDA网站)
加拿大Health Canada发布关于Boston Scientific公司因心房-食管瘘风险更新说明书内容召回Polarx FIT短尖和长尖低温消融球囊导管的警示信息 发布日期:2024年10月15日 召回级别:I级 召回产品:Polarx FIT短尖和长尖低温消融球囊导管,具体型号和批号见下表:
召回原因:Boston Scientific公司正在针对POLARx 如需更多信息,请联系制造商。 (加拿大Health Canada网站)
美国FDA发布Medtronic公司因电池使用寿命短于预期的风险召回MiniMed 600和700系列胰岛素泵的警示信息 发布日期:2024年10月17日 召回级别:此次召回并不涉及移除所有产品。如果用户发现电池寿命明显缩短,应联系Medtronic公司,以确定是否需要更换新的泵。美国FDA已将此次召回确定为最严重的召回类型。 受影响的产品 https://www.fda.gov/medical-devices/medical-device-recalls/insulin-pump-recall-medtronic-notifies-users-minimed-600-and-700-series-pumps-risk-shorter-expected 图:MiniMed 670G胰岛素泵和MiniMed 780G胰岛素泵 产品用途:MiniMed 600和700系列胰岛素泵是由电池供电的便携式胰岛素泵,用于为需要胰岛素的糖尿病患者提供胰岛素以管理疾病。这些泵还用于接收、储存和显示来自传输设备的血糖(葡萄糖)值。 召回原因:Medtronic公司正在通知所有MiniMed 600和700系列胰岛素泵的用户,原因是电池寿命缩短和电池警告发生后至关机的时间缩短的风险增加。泵发生掉落、碰撞或经历过其他物理冲击可能会损坏电气元件,从而导致上述问题——即使是一次掉落也会影响电池寿命。这可能导致泵在明显早于预期的时间点停止输送胰岛素。 使用受影响产品可能会造成严重的不良健康后果,包括高血糖(高血糖症)、脂肪在体内分解过快(糖尿病酮症酸中毒)和死亡。 从2023年1月到2024年9月,Medtronic公司收到170份高血糖报告,>400mg/dL,以及11份糖尿病酮症酸中毒报告。目前没有收到死亡报告。 采取措施 2024年7月31日,Medtronic公司向所有受影响的客户发送了一份安全警告,指出用户应该关注MiniMed 600系列和700系列胰岛素泵的内置警报和电池状态报警。如果用户观察到泵的电池寿命发生变化,请联系Medtronic公司。 2024年10月4日,Medtronic公司发布了一份更新信息:紧急医疗器械更正函。2024年10月的信函中概述了以下需要采取的措施: (美国FDA网站)
美国FDA发布关于Boston Scientific公司因用于胃肠道出血时缺血风险增加更新Obsidio栓塞剂使用说明书的警示信息 发布日期:2024年10月18日 此次召回涉及更新这些产品的使用说明书,这些更新是在Boston Scientific公司2024年2月20日发布的说明书基础上进行的更新,不涉及将产品从使用单位或销售机构移除。美国FDA已将此次召回确定为最严重的召回类型。如果不按照更新后的说明书继续使用本产品,可能会造成严重的人身伤害甚至死亡。 受影响产品 https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfres/res.cfm?id=206388 产品用途:Obsidio栓塞剂是一种预混栓塞剂,通过微创方式输送,用于阻断(闭塞)特定血管的血流。注射后,Obsidio栓塞剂在血管中形成固体铸件,阻止血液流动。产品旨在用于一次性栓塞高血管肿瘤和阻断(闭塞)正在流血或大出血的外周血管的血流。 更新使用说明书的原因: Boston Scientific公司正在更新Obsidio栓塞剂的使用说明书,原因是担心在胃肠道区域使用该产品的风险。之前有过与下消化道出血相关的严重不良健康后果。近期涉及所有消化道出血的严重不良健康后果。 使用该产品进行分份法或用生理盐水推进可能导致目标外栓塞、缺血(阻止血液和氧气流向器官),包括小肠缺血,可能导致住院时间延长、需要额外手术(如肠切除或分流造口术)或死亡。 Boston Scientific公司不建议通过使用分份法或生理盐水推进来改变Obsidio栓塞剂。 目前已有与此相关的15份伤害和4份死亡报告。 采取措施: 遵循更新后的使用说明书。2024年10月11日,Boston Scientific公司向所有受影响的客户发送了一封更新的紧急医疗器械忠告函,建议采取以下行动: (美国FDA网站)
|
|


 加拿大Health Canada发布关于Olympus Medical公司因性能问题召回胃肠道视频内窥镜的警示信息
加拿大Health Canada发布关于Olympus Medical公司因性能问题召回胃肠道视频内窥镜的警示信息